Naure Communications:高原适应调控机制研究最新成果
文章来源 :
2020-10-13 14:43
2020年10月1日Nature Communications杂志以“Chromatin accessibility landscape and regulatory network of high-altitude hypoxia adaptation”为题发表了中国科学院昆明动物研究所与西藏大学等单位合作完成的有关人类对高原低氧环境适应的调控机制的最新成果,构建了人类对高原低氧环境适应的染色质可及性与调控网络图谱,为挖掘高原藏族人群适应高寒环境背后的调控元件等特有遗传资源提供了新的基础数据。
对高原低氧环境适应的分子机制是进化和遗传领域的核心科学问题,长期以来受到广泛的关注。自2010年以来,由中科院昆明动物研究所与西藏大学的科研团队,通过系统分析高原藏族人群生理表型和基因组学数据,挖掘了包括EPAS1和EGLN1在内的一系列与藏族高原适应相关的候选基因等特有遗传资源(Peng et al. Mol Biol Evol 2011; Xiang et al. Mol Biol Evol 2013; Yang, et al. Hum Mut 2016; Zheng et al. Zool Res 2017; Guo et al. Zoo Res 2017; Ouzhuluobu et al. Nat Sci Rev 2020),并初步揭示了藏族人群对高原低氧环境的生理适应机制(Peng et al. Mol Biol Evol 2017; He et al. Nat Sci Rev 2018)。然而,鉴于已发现的绝大部分在藏族人群中富集的适应性突变都发生在非编码区域,为系统破译这些位点的分子调控机制和功能效应带来了极大挑战。
近年来,多组学技术尤其是表观染色质状态和三维结构测序技术的发展和广泛应用,对解析这些非编码区域变异的调控机制带来了契机。为了系统解析藏族人群适应高原低氧的分子调控机制,中科院昆明动物所宿兵教授与中科院数学与系统研究院王勇教授等合作,利用脐带内皮细胞(HUVEC)的人工低氧环境模拟实验,采集了低氧处理不同时间节点上的细胞的多组学数据,包括基因组、转录组、染色质可及性(ATAC-seq)和染色质空间构象(Hi-C)数据,进一步发展了一种新型方法论框架:vPECA (Variants interpretation model by Paired Expression and Chromatin Accessibility data,利用成对表达与染色质可及性数据解析突变位点的调控网络的分析模型),即整合细胞的基因组-表观组-转录组-表型层面的数据,构建以受选择调控元件为核心的基因调控网络模型,对藏族人群对高原低氧环境适应的调控机制进行了系统分析。该模型可以检测位于非编码区变异位点是否在群体中受到选择,同时又位于具有调控活性的调控元件上,并在调控网络中影响下游基因表达水平。我们利用该模型揭示EPAS1基因表达由受选择和不受选择两类调控元件组合调控,进一步发现了3个位于增强子区域的功能位点,这3个位点通过削弱所在区域的染色质开放程度(可及性),进而下调EPAS1的表达,从而避免藏族人群在高原低氧环境红细胞的过度增生。同时,研究人员还构建了EPAS1基因的下游调控网络,解析了下游受选择靶基因的调控机制,在网络中探索了高原适应相关表型的联系,并尝试了对肺动脉高压SNP和藏族特异的结构变异的调控机理注释。
该研究提供了一个群体遗传数据结合特定细胞环境多组学数据的研究范例,包括基于多组学数据系统破译非编码区变异位点的调控方式和基于组学数据动态变化特征构建基因调控网络的统计模型,为今后利用多组学整合数据分析挖掘特定遗传资源提供了一个非常有效的工具。同时,该研究进一步揭示了EPAS1对藏族低氧适应的贡献,并系统解析了低氧适应的调控网络,为高原藏族人群中的特有遗传资源挖掘和低氧通路的调控机制研究提供了重要的基础数据。
丝路环境专项项目五中科院昆明动物所宿兵教授、数学与系统研究院王勇教授和Wing Hung Wong教授为论文的共同通讯作者。信晶雪博士、张慧助理研究员,和耀喜副研究员、都仁扎那博士和白彩娟博士为论文的共同第一作者。该研究受到国家自然科学基金委“微进化”重大研究计划集成项目与中科院战略先导专项A类课题的共同资助。
原文链接:https://www.nature.com/articles/s41467-020-18638-8
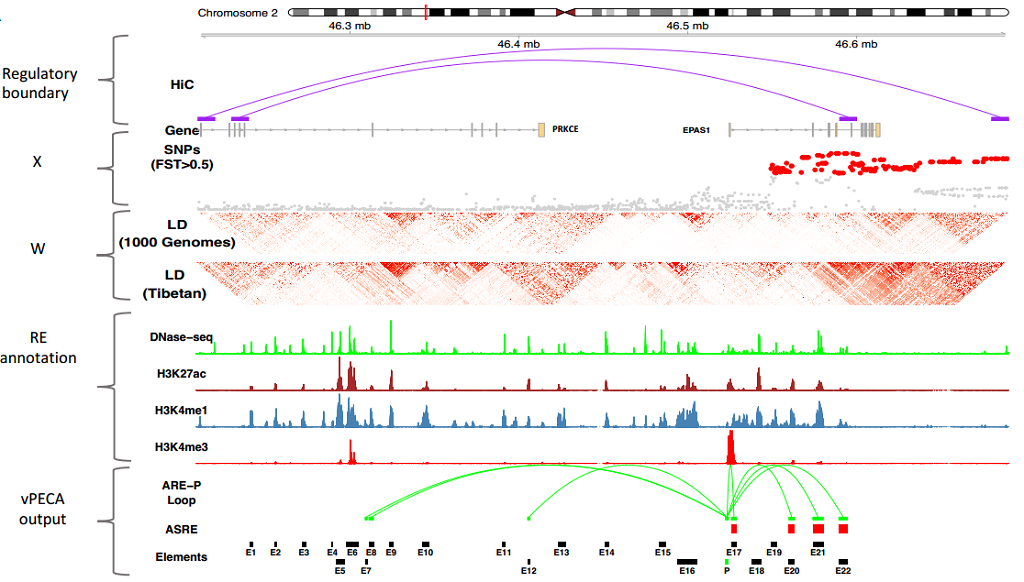
图注:发展vPECA模型揭示EPAS1低氧适应的分子调控机制